糖ペプチドはアミノ酸と糖の結合の仕方により、O型糖化、C a N型糖化、露糖化、GPI(グリコホスファチドリイノシトール)結合の4つに分類されます。
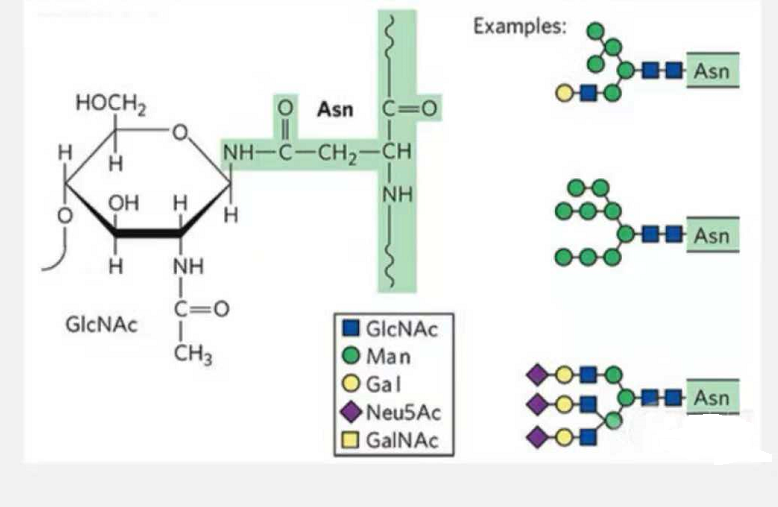
1. N-グリコシル化糖ペプチドは、ペプチド鎖の一部の Asn の側鎖のアミド基上の N 原子に結合したグリカン鎖 (Glc-Nac) の還元末端の N-アセトアミド グルコースで構成され、Asn はグリカン鎖を結合できるアミノ酸は、残基によって形成されるモチーフの AsN-X-Ser /Thr (X! =P) に位置する必要があります。糖質はN-アセチルグルコサミンです。
N-グリコシル化修飾構造糖ペプチド
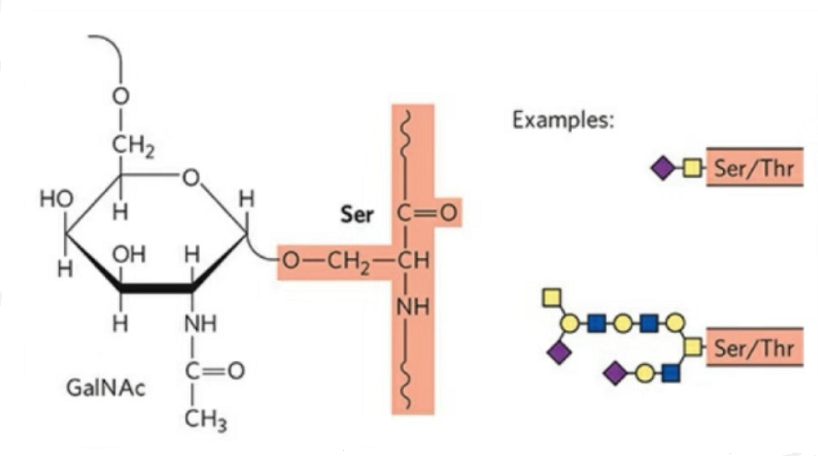
2. O-グリコシル化の構造は N-グリコシル化よりも単純です。この糖ペプチドは一般にグリカンよりも短いですが、N-グリコシル化よりも多くの種類があります。通常、Ser と Thr はペプチド鎖内でグリコシル化されます。さらに、チロシン、ヒドロキシル、およびヒドロキシプロリングリコシル化で修飾された糖ペプチドもあります。結合位置は、残基の側鎖上のヒドロキシル酸素原子です。結合した糖は、ガラクトースまたは N-アセチルガラクトサミン (Gal&GalNAc) またはグルコース/グルコサミン (Glc/GlcNAc)、マンノース/マンノサミン (Man/ManNAc) などです。
O-グリコシル化により構造が変化する
3. 糖ペプチド O-GlcNAC グリコシル化 ((N-アセチルシステイン (NAC)) (glcnAcN-アセチルグルコサミン/アセチルグルコサミン)
単一の N-アセチルグルコサミン (GlcNAc) グリコシル化により、タンパク質 O-GlcNAc がタンパク質のセリンまたはスレオニン残基のヒドロキシル酸素原子に結合されます。O-GlcNA グリコシル化は、グリカン伸長のない O-GlcNAc 単糖の装飾です。ペプチドのリン酸化と同様に、糖ペプチドの O-GlcNAc グリコシル化も動的なタンパク質修飾プロセスです。異常な O-GlcNAc 装飾は、糖尿病、心血管疾患、腫瘍、アルツハイマー病などのさまざまな病気を引き起こす可能性があります。
糖ペプチドの糖鎖修飾点
ポリペプチドや糖鎖の基本構造は共有結合によってタンパク質鎖に結合しており、糖鎖を結合する部位を糖鎖修飾部位といいます。糖ペプチド糖鎖の生合成を追跡するためのテンプレートがないため、異なる糖鎖が同じグリコシル化部位に結合し、いわゆる顕微鏡的不均一性が生じます。
糖ペプチドのグリコシル化
1. 治療用タンパク質の治療効果に対する糖ペプチドのグリコシル化の影響
治療用タンパク質の場合、グリコシル化は生体内でのタンパク質薬剤の半減期と標的化にも影響を与える
2. 可溶性糖ペプチドのグリコシル化とタンパク質
研究により、タンパク質表面の糖鎖がタンパク質の分子溶解性を改善できることが示されています。
3. 糖ペプチドのグリコシル化とタンパク質の免疫原性
一方で、タンパク質表面の糖鎖は特異的な免疫応答を誘導する可能性があります。一方、糖鎖はタンパク質表面の特定の表面を覆い、その免疫原性を低下させる可能性があります。
4. タンパク質の安定性を高める糖ペプチドのグリコシル化
グリコシル化により、さまざまな変性条件 (変性剤、熱など) に対するタンパク質の安定性が高まり、タンパク質の凝集が回避されます。同時に、タンパク質表面の糖鎖はタンパク質分子のタンパク質分解点の一部をカバーすることもできるため、プロテイナーゼに対するタンパク質の耐性が高まります。
5. タンパク質分子の生物活性に影響を与える糖ペプチドのグリコシル化
タンパク質のグリコシル化を変化させると、タンパク質分子が新たな生物学的活性を形成できるようになります
投稿日時: 2023 年 8 月 3 日