アミノ酸とは何ですか?
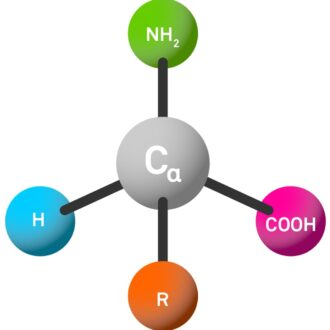
自然界で最も一般的なアミノ酸は、α-アミノ酸と呼ばれます。これらの分子には、中心炭素原子(α-C原子と呼ばれる)に付着した4つの異なる置換基があります。
アミノ (nh₂、3文字のコードは「h-」と略されました)。
カルボン酸基 (COOH、3文字のコードで「-oh」と略されます)。
サイドチェーン(R、これは非常に多様であり、アミノ酸の特性と最終ペプチドを決定します)。
水素原子 (h)。
α-C原子のこれら4つの異なるグループに接続すると、独自の化学的特性が得られ、アミノ酸とペプチドの挙動と特性を決定する上で重要な役割を果たします。
アミノ酸の生物活性
アミノ酸は、次のような生物学的活動を示すことができます。
トリプトファン(TRP)とグルタミン酸(GLU)は、代謝プロセスで重要な役割を果たします。
Rグループ(またはサイドチェーン)は、アミノ酸のユニークな特性を決定します。これらのグループは:
簡単に言えば:グリシン(Gly)のような水素原子。
他の酸が含まれています: アスパラギン酸(ASP)やグルタミン酸(GLU)など。
基本グループのキャリー:アルギニン(ARG)、リジン(LYS)またはヒスチジン(HIS)。
極グループが含まれています: セリン(Ser)やスレオニン(Thr)など。
非極性炭化水素:アラニン(ALA)、フェニルアラニン(PHE)またはバリン(VAL)。
硫黄含有量:システイン(CYS)およびメチオニン(MET)に見られるように。
L-アミノ酸とD-アミノ酸の役割
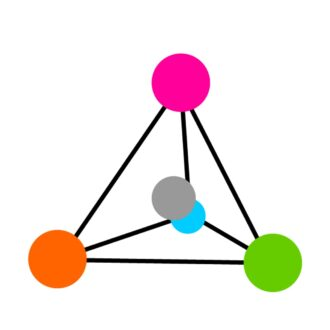
α-C原子の4つの置換基は、四面体の角に配置され、α-C原子が中心にあります(図3を参照)。この配置により、2つの形態のアミノ酸分子は、左手と右手と同様に、鏡の形で存在することができます。これらのミラー形式は、「立体異性体」または「エナンチオマー」として知られています。
エナンチオマーの生物学的重要性
エナンチオマーはほぼ同一の化学的特性と物理的特性を持っていますが、それらの生物学的効果は大幅に異なる場合があります。分子形状は、生物学的標的との相互作用にとって重要です。 1つのエナンチオマーはターゲットに効果的に結合する場合があり、別のエナンチオマーはターゲットに効果的に結合する場合があります。溶液中、エナンチオマーは偏光平面を反対方向に回転させます。
投稿時間:2025-09-05
