CYCLO (ARG-GLY-ASP-D-PHE-LYS) /161552-03-0/GTペプチド/ペプチドサプライヤー
説明
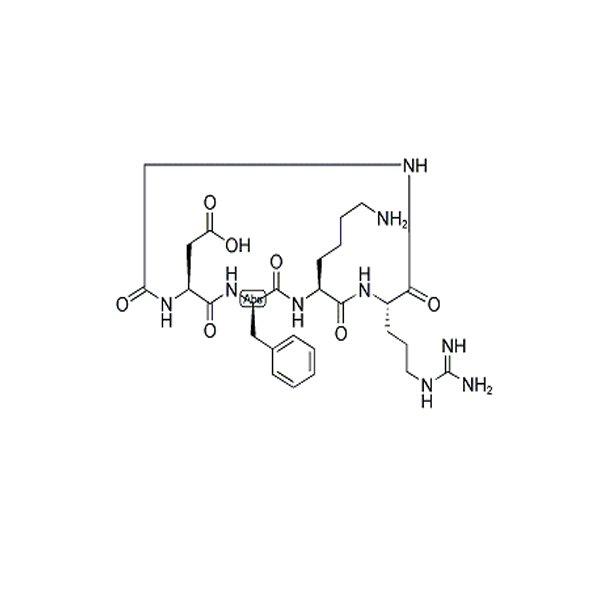
Cyclo(-RGDfK) は、インテグリン _alpha_v_beta_3 の効率的かつ選択的な環状ペプチド阻害剤であり、科学研究に使用できます。シクロ (-RGDfK) は、強力かつ選択的な阻害剤です。αvβ3 インテグリン、IC50 は 0.94nM。[(66) Ga]DOTA-E-Chemicalbook[c (RGDfK)]2 は、高い放射化学的純度 (> 97%)、比放射能 (36-67 GBQ /μM)、インビトロ安定性および適度なタンパク質結合を調製する。
仕様
外観:白色からオフホワイトの粉末
純度(HPLC):≥98.0%
単一の不純物:≤2.0%
酢酸含量(HPLC): 5.0%~12.0%
水分含有量 (カールフィッシャー):≤10.0%
ペプチド含有量:≥80.0%
梱包と配送: 低温、真空梱包、必要に応じて mg まで正確に梱包します。
注文の仕方?
1. Contact us directly by phone or email: +86-13735575465, sales1@gotopbio.com.
2. オンラインで注文します。オンライン注文フォームにご記入ください。
3. ペプチド名、CAS 番号または配列、必要に応じて純度および修飾、数量などを入力してください。2 時間以内にお見積りを提出します。
4. 正式に署名された販売契約およびNDA(秘密保持契約)または機密契約に基づいて注文を確認します。
5. 注文の進捗状況を適時に継続的に更新します。
6. DHL、Fedex などによるペプチド配送、HPLC、MS、COA は貨物とともに提供されます。
7. 当社の品質またはサービスに相違がある場合は、返金ポリシーに従います。
8.アフターサービス:実験中にお客様が当社のペプチドについてご質問がある場合は、お気軽にお問い合わせください。すぐに対応させていただきます。
当社のすべての製品は科学研究目的のみに使用されます。'個人が人体に直接使用することは禁止されています。
よくある質問:
Cysを含むペプチドは出荷前に低減されていますか?
ペプチドが酸化されていることが確認されない場合、通常は Cys を還元しません。すべてのポリペプチドは、Cys の酸化を少なくともある程度防止する pH2 条件下で精製および凍結乾燥された粗生成物から得られます。Cys を含むペプチドは、pH6.8 で精製する特別な理由がない限り、pH2 で精製されます。精製が pH6.8 で行われる場合、酸化を防ぐために精製生成物を直ちに酸で処理する必要があります。最終の品質管理ステップで、Cys を含むペプチドについて、MS マップ上で分子量 (2P+H) 物質の存在が検出された場合は、二量体が形成されていることを示します。MS、HPLCに問題がなければそのまま凍結乾燥して出荷いたします。Cysを含むペプチドは時間の経過とともにゆっくりと酸化され、酸化の程度はペプチド配列と保存条件に依存することに注意してください。
ペプチドがループしているかどうかをどのように判断しますか?
エルマン反応を使用して、リング形成が完了したかどうかをテストします。エルマンテストが陽性(黄色)の場合、リング反応は不完全です。テスト結果が陰性(黄色ではない)の場合、リング反応は完了しています。弊社ではお客様向けに環化同定の分析レポートは提供しておりません。一般に、QC レポートにはエルマンのテスト結果が記載されます。
トリプトファンを含む環状ペプチドが必要ですが、酸化されますか?
トリプトファンの酸化はペプチドの酸化では一般的な現象であり、ペプチドは通常、精製前に環化されます。トリプトファンの酸化が起こると、HPLC カラム上でのペプチドの保持時間が変化し、酸化は精製によって除去できます。さらに、酸化ペプチドも MS で検出できます。
ペプチドと色素の間に隙間を設ける必要はありますか?
大きな分子(色素など)をペプチドに結合させる場合は、ペプチド自体の折り畳みやペプチドの折り畳みによる受容体への干渉を最小限に抑えるために、ペプチドとリガンドの間にスペースを置くことが最善です。その共役。間隔を望まない人もいます。例えば、タンパク質のフォールディングでは、特定の部位に蛍光色素を付着させることで、アミノ酸のフォールディング構造がどの程度離れているかを知ることができます。
N末端にビオチン修飾を加えたい場合、ビオチンとペプチド配列の間にギャップを入れる必要がありますか?
当社が使用する標準的なビオチン標識手順は、ペプチド鎖に Ahx を付加し、続いてビオチンを付加することです。Ahx は、ペプチドとビオチンの間の障壁として機能する 6 炭素化合物です。
リン酸化ペプチドの設計についてアドバイスをいただけますか?
長さが長くなると、リン酸化アミノ酸から結合効率が徐々に低下します。合成方向はC末端からN末端へです。リン酸化アミノ酸以降の残基数が 10 を超えないこと、つまりリン酸化アミノ酸の前の N 末端から C 末端までのアミノ酸残基数が 10 を超えないことが推奨されます。
なぜn末端アセチル化とC末端アミド化なのでしょうか?
これらの修飾により、ペプチドの分解が防止され、ペプチドが親タンパク質のαアミノ基とカルボキシル基の元の状態を模倣できるようになります。